Приведено исчерпывающее описание коллекционного материала фасоли овощной обыкновенной (Phaseolus vulgaris L.) по происхождению и хозяйственно-ценным признакам с точки зрения пригодности уборки для производственной линии в условиях Алматинской области. Изучен вегетационный период отобранных сортов фасоли, что позволяет ежегодно производить кондиционированные семена исследуемого поля. Определены раннеспелые и среднеспелые формы овощных бобов, пригодные для выращивания в Алматинской области. Показано, что продолжительность вегетационного периода исследуемого материала овощных бобов колеблется в пределах 71–85 дней. Указаны наиболее урожайные сорта фасоли для условий Алматинской области. Установлены корреляционные связи между урожайностью и составляющими продуктивности по массе стручков зеленых овощей. Согласно структурному анализу коллекции по урожайности в изучаемой зоне, наиболее перспективными и адаптированными сортами и линиями в раннеспелом кластере являются сорта «Лаура» и «Луна», урожайность которых превышает урожайность эталонного сорта на 22–37 %. В то же время среднеспелый кластер выявил сорт «Касабланка» (Польша), который показал на 26 % более высокую урожайность по сравнению с урожаем того же эталона. Устойчивость отобранных представителей фасоли коллекции к антракнозу исследована с помощью молекулярно-генетического маркирования генотипов.
Введение
Важнейшей задачей современного агропроизводства является обеспечение высоких и стабильных урожаев, в том числе и в зонах, относящихся к возделыванию монокультур и испытывающих регулярное воздействие различных внешних стрессоров. По данным Министерства сельского хозяйства РК, только с 2011 по 2015 гг. площади зернофуражных, крупяных и бобовых культур были расширены на 36 % [1]. Фасоль является одной из значимых культур, которая обладает многоцелевой пищевой, кормовой, фармацевтической, почвообогащающей и севооборотной ценностью. Однако данная культура широко не возделывается в ряде регионов страны в связи с отсутствием в генофонде зернобобовых культур генотипов, устойчивых к болезням и вредителям, а также форм с высоким адаптивным потенциалом. Вместе с тем постепенно развертывается применение фасоли в виде овощной (лопаточной) культуры, декоративной культуры и источника белковых компонентов в современном кормопроизводстве на уровне крупных и мелких фермерских хозяйств страны.
В настоящее время в Государственный реестр селекционных достижений входит всего 5 сортов овощной фасоли, которые районированы в Республике Казахстан, в том числе 4 — зарубежной селекции, 2 сорта — зарегистрированы еще в 1943 г., 1 — казахстанский сорт «Ассоль» (регистрация в 2012 г.) [2].
Несмотря на то, что агрономический ареал культуры требует устойчивого расширения, большинство районированных сортов, возделываемых в производстве, недостаточно устойчивы к различным экологическим факторам. Поэтому необходима целенаправленная работа по созданию, районированию и внедрению в производство высокопродуктивных сортов, способных максимально реализовать свои потенциальные возможности в конкретных климатических условиях. В связи с этим актуальным является комплексное изучение лучших отечественных и зарубежных сортообразцов и линий, выявление источников хозяйственно-ценных признаков для расширения генофонда фасоли, поиска доноров и источников устойчивости к стрессорам.
В Казахстане поддержанием коллекции зернобобовых культур на протяжении последних 12 лет занимается кафедра молекулярной биологии и генетики Казахского национального университета им. аль-Фараби в условиях предгорной и степной зоны Алматинской области. Генофонд фасоли Phaseolus vulgaris L. насчитывает 97 образцов и увеличивается как за счет гибридизации, так и в процессе популяционного и спонтанного мутагенеза. Поэтому актуальны процедуры маркирования и исследования коллекционных сортообразцов фасоли овощной по хозяйственно-ценным признакам для выделения исходного материала для селекции по признакам качества семян и для разработки технологии конвейерного производства.
Цель работы — проведение оценки образцов фасоли овощной по таким морфогенетическим и физиологическим признакам, как продолжительность вегетационного периода, продуктивность растений, устойчивость к антрокнозу при выращивании в условиях Алматинской области.
Материалы и методы
Опыты проводились в полевом севообороте в условиях в предгорной и степной (равнинной) зонах Алматинской области. Климат Алматинской области резко континентальный, средняя температура января в равнинной части –15 ºС, в предгорьях 6–8 ºС; июля +16 ºС и +24…+25 ºС, соответственно. Годовое количество осадков на равнинах — до 300 мм, в предгорьях и горах от 500–700 до 1000 мм в год. Продолжительность вегетационного периода в предгорьях и на равнине достигает 205–225 дней. Опыты закладывались по методическим указаниям по экологическому сортоиспытанию овощных культур в открытом грунте [3]. Размер учетной делянки составлял 4,2 м2, делянка имела двурядную форму, длина ряда достигала 3,0 м, расстояние между рядами — 0,7 м, расстояние между растениями — 8–10 см, количество растений в каждом ряде — 30, всего растений на учетной делянке 60 шт. Референтный сортообразец (сорт для сравнения) — «Ассоль», селекции КазНИИКО, полученный из коллекционного местного образца методом популяционного отбора, допущенный к использованию по Алматинской области с 2012 г. В 2012 г. сорт «Ассоль» был защищен авторским свидетельством № 438 от 23 апреля 2012 г. [2].
В качестве объектов исследования были отобраны сортообразцы фасоли зарубежной и казахстанской селекций, выделенные из изучаемой коллекции по хозяйственно-ценным признакам: «Касабланка» (Польша), «Vaillant» (Франция), «Лаура» (Россия), «Montano» (Финляндия), «Луна» (Чехия), «Катка», «Kinghorn Wax» (Австрия), «Местная» (Венгрия), «Балонг» (Италия), «Пурпурный король» (Россия). Изучение образцов фасоли овощной проводилось по методикам ВИР и полевого опыта в овощеводстве и бахчеводстве. Оптимальный срок посева семян в открытый грунт для условий Алматинской области — с 5 по 20 мая. Посев образцов проводили вручную на делянках, как описано выше, в четырехкратной повторности. Ряды располагались с севера на юг, крайние занимали защитные полосы. Уход за посевами включал ручные прополки с окучиванием, систематическое рыхление почвы в междурядьях, которые проводили по мере необходимости. Первый раз междурядья обрабатывали при появлении полных всходов. Сбор зеленых бобов (лопаток) проводили вручную выборочным методом в пределах рамок площадью 1 м2, т.е. троекратно на делянку.
Статистическую обработку данных, обработку биометрических показателей и фенологических наблюдений проводили, используя методы дисперсионного и корреляционного анализа по Б.А. Доспехову [4].
Выделение ДНК фасоли. В настоящее время маркерная селекция (MAS-селекция) используется для изучения генетического разнообразия, генотипа, определения генов толерантности и эффективного использования селекционных программ. Метод CTAB [5] использовался для выделения ДНК фасоли. Необходимые реагенты для СТАВ-буфера: 2 % CTAB (10,0 г), 1,4 М NaCl, 20 мМ ЭДТА (20 мл 0,5 М ЭДТА), 100 мМTris-HClpH 8 (50 мл 1,0 М Tris-HCl доводились бидистиллированной водой до 500 мл). ТЕ-буфер: 10 мМTris-HCl, pH 8,0; 1 мМ ЭДТА. Хранение при пониженной температуре в пределах 2–8 ºС.
Для анализа методом ПЦР использовали маркер SCAR SY20830C (5ʹ-AGC CGT GGA AGG TTG TCA T-3ʹ и 5 ʹ-CCG TGG AAA CAA CAC ACA AT-3ʹ), ассоциированный с локусом Со-4. Выбор данного гена обусловлен тем, что именно локус Со-4 отвечает за наиболее мощную устойчивость фасолевых генотипов к антракнозу [6].
ПЦР-анализ по маркеру SCAR SY20830C. ПЦР проводили с помощью набора PCR MasterMix (Thermo Fisher Scientific, США). Праймеры были синтезированы на синтезаторе ASM-800 (Новосибирск, Россия) в Институте общей генетики и цитологии КН МОН РК. Специфическая амплификация ДНК по маркеру SCAR SY20830C (далее SY20) проводилась в следующем режиме: первичный цикл денатурации проводили при 94 ºС в течение 3 мин; затем следовали 30 циклов при 94 ºС в течение 10 с, при 65 ºС в течение 30 с, при 72 ºС в течение 1 мин; элонгацию проводили при 72 ºС в течение 5 мин. Продукты амплификации фракционировали при электрофорезе в 2 % агарозе с использованием краски Gel Red Nucleic Acid Gel Stain (Biotium, США). В качестве молекулярного маркера использовали GeneRuler 100 bp DNA Ladder (Thermo Fisher Scientific, США). Гели визуализировали с помощью гель-документирующей системы Quantum-ST5 (Vilber Lourmat, Франция).
Результаты и обсуждение
Возделывание фасоли обыкновенной обусловлено тем, что отдельные формы и сорта резко различаются как по экологическим характеристикам, так и по параметрам вегетативного и репродуктивного роста. Знание этих особенностей является необходимым условием для разработки научно обоснованной агротехники, дифференцированной для форм и сортов фасоли применительно к определенным районам. В связи этим было изучена продолжительность вегетационного периода изучаемых образцов фасоли. Образцы, согласно Международному классификатору СЭВ культурных видов рода Phaseolus L., были подразделены на три группы по скорости созревания семян: раннеспелые, среднеспелые, позднеспелые (табл. 1).
Для изучения вегетационного периода и продуктивности овощной фасоли использовали 11 сор- тообразцов по 150 растений. В качестве стандарта использовали сорт «Ассоль». Наблюдения проводили в 2017–2018 гг. в полевых условиях на базе агробиостанции «Жана Талап» КазНУ им. альФараби (табл. 1).
Таблица 1
Общая продолжительность вегетационного периода образцов фасоли за 2017–2018 гг.
|
Образец |
Кол-во дней от посева до массовых всходов |
Кол-во дней от массовых всходов до массового цветения |
Кол-во дней от массовых всходов до массовой технической спелости |
Кол-во дней от массовых всходов до массовой биологической спелости |
Группа спелости: раннеспелые (РС), среднеспелые (СС) |
|
«Ассоль» (Казахстан) |
14,0±0,9 |
32,0±0,8 |
45,0±0,1 |
85,0±0,8 |
СС |
|
«Касабланка» (Польша) |
11,9± 0,5* |
30,0±0,1** |
42,0±0,8 |
81,0±0,4** |
СС |
|
«Vaillant» (Франция) |
10,8±0,1* |
34,0±0,6* |
49,3±0,6** |
82,5±0,6* |
СС |
|
«Лаура» (Россия) |
12,8±0.1* |
33,7±0,1 |
41,5±0,5** |
75,9±0,5*** |
РС |
|
«Montano» (Финляндия) |
13,0±0,3* |
35,8±0,7** |
45,4±1,1 |
72,8±0,7*** |
РС |
|
«Луна» (Чехия) |
12,0±0,9* |
31,0±0,5 |
45,9±0,1 |
75,0±0,9 |
РС |
|
«Kinghorn Wax» (Австрия) |
12,9±0,1* |
32,5±0,3 |
42,4±0,2** |
71,7±0,4*** |
РС |
|
«Местная» (Венгрия) |
13,7±0,2* |
34,3±0,5* |
50,0±0,4** |
75,0±0,8*** |
РС |
|
«Балонг» (Италия) |
14,0±0,1 |
35,0±0,6** |
50,0±0,3** |
85,0±0,1 |
СС |
|
«Пурпурный король» (Россия) |
12,0±0,2* |
32,0±0,3 |
45,8±0,5 |
71,0±0,1*** |
РС |
|
ФСО-207–2 |
14,0±0,2 |
32,0±0,4 |
46,0±0,1 |
85,0±0,9 |
СС |
Примечание. * — при Р > 0,95; ** — при Р > 0,99; *** — при Р > 0,999.
Во время исследования продолжительность вегетационного периода образцов фасоли варьировала в пределах 71–85 суток. В результате исследования все образцы были отнесены к двух группам, а именно ранних и среднеспелых сортообразцов.
Наиболее интересны сортообразцы «Катка», «Kinghorn Wax» и «Пурпурный король», «Местная» продемонстрировала самый короткий вегетационный период (рис. 1).
Продолжительность вегетационного периода этих сортов находилась в высокой зависимости от погодных условий. Так, вегетационный период сорта «Kinghorn Wax» составил в 2017 г. — 71 сутки, в 2018 г. — 75 суток; вегетационный период сорта «Пурпурный король», соответственно, 71 и 74 суток. Именно последний сортообразец рекомендуется нами в качестве источника признака скороспелости для использования в селекционной работе. Таким образом, изучение продолжительности вегетации у фасоли овощной в условиях Алматинской области показало, что сортообразцы можно разделить на две группы спелости: скороспелые (период вегетации до 85 суток), среднеспелые (от 86 до 95 суток). Среди изучаемых сортов не оказалось позднеспелых (96 и более суток) сортообразцов.

Установлено, что при возделывании в условиях Алматинской области перспективными являются скороспелые и среднеспелые сорта фасоли, которые имеют такой период вегетации, позволяющий ежегодно получать кондиционные семена этой культуры.
Продуктивность сортов фасоли овощной является сложным признаком, зависящим как от генотипа, так и от условий выращивания. В то же время данный сложный признак относится к одним из главных критериев оценки сорта. При создании зеленого конвейера в наших исследованиях продуктивность сортообразцов фасоли овощной анализировалась по следующим показателям: количество бобов на растении, масса бобов, средняя урожайность зеленых бобов и форма растений. Потенциальная возможность продуктивности фасоли велика. На каждом растении образуется от 150 до 200 цветков, однако не более 20–40 % из них завязываются [7]. При этом детерминантные сорта имеют больший процент образования бобов, чем недетерминантные. В процессе оценки коллекции нами были идентифицированы наиболее оптимальные сортообразцы фасоли овощной по признаку количества бобов на растение (табл. 2). У коллекционных образцов число бобов изменялось в зависимости от условий года и варьировало от 7,1 до 30,2 шт. на растение. Для создания зеленого конвейера важны масса боба и форма самого растения. В связи с этим нами были отобраны сорта с округлой формой и наименьшей массой единичного боба.
Как видно из таблицы 2, наименьшей массой боба обладали такие сорта, как сортообразец раннеспелой группы «Montano» — 5,7 г и сортообразец среднеспелой группы «Vaillant» — 4,5 г. А также «Касабланка» — 5,5 г относительного стандартного отечественного сортообразца «Ассоль» (6,1 г). Проведенные исследования сортообразцов фасоли овощной позволили установить, что наилучшими по качеству среди них являются те, у которых бобы продолжительный период не грубеют и не склонны к образованию пергаментного слоя и волокна в течение всего периода вплоть до уборки. Выделенные из коллекции образцы не только превосходили остальные по количеству зеленых бобов, но и соответствовали требованиям, предъявляемым к качеству боба (рис. 2).
Урожайность зеленых бобов складывается в основном из двух элементов структуры — количества растений на единицу площади и массы бобов с одного растения. Для расчета был проведен подсчет количества растений с 1 м2. В связи с тем, что все работы по уходу за растениями проводились вручную, их сохранность на делянке составляла от 94 до 100 %. При этом урожайность бобов варьировала от 344,1 до 558,2 г. По сбору бобов с 1 м2 были отмечены такие сортообразцы, как в раннеспелой группе «Лаура» и «Луна», у которых урожайность превосходила таковую у сорта-стандарта на 22–37 %; в среднеспелой группе сортообразец «Касабланка» — на 26 % выше, чем урожайность того же стандартного сортообразца. Образцы «Лаура», «Касабланка» превысили сорт-стандарт «Ассоль» по продуктивности более чем на 100 г. В нашем опыте уровень разброса вариабельности признака урожайности зеленых бобов среди раннеспелых и позднеспелых сортов был невысоким.
Изучение корреляционной связи между урожайностью и элементами продуктивности зеленых бобов показало роль дополнительных факторов. Например, было отмечено, что ощутимые потери урожая фасоли вызываются различными заболеваниями. Одним из широко применяемых методов защиты растений от патогенов являются создание и использование устойчивых к болезням сортов и линий сельскохозяйственных культур. В настоящее время в Казахстане около 9 тыс. га сельскохозяйственных земель заражено вредителями и распространено около 70 видов болезней. Потери урожая зерновых и зернобобовых культур от грибных болезней достигают 30 % [8]. Для решения этой проблемы актуальным является определение перспективных сортов, адаптированных к конкретным почвенно-климатическим условиям и устойчивых к болезням. Подобная постановка вопроса будет способствовать расширению ареала возделывания данной культуры. Среди заболеваний наиболее вредоносным является антракноз, вызываемый грибковым патогенном Colletotricum lindemuthianum. Антракноз проявляется в том, что часть посеянных семян не всходит или погибает в фазе прорастания, не достигнув поверхности почвы. На семядолях и гипокотиле остальных растений развиваются красно-бурые или черные концентрические пятна, которые могут вызвать гибель молодых растений. Распространение возбудителя во время вегетации осуществляется конидиями, которые разносятся с каплями осадков, ветром, насекомыми и т.д. Развитие болезни может усиливаться при увеличении температуры или при воздействии продолжительных осадков [9].
Успешная борьба с болезнями растений объясняется своевременным выявлением заболеваний и правильной идентификацией возбудителей на основе молекулярно-генетических методов [10]. Среди всех генов устойчивости фасоли андского типа (Co-1, Co-12, Co-13, Co-14, Co-15, Co-w, Co-x, Co-y и Co-z) ассоциированные с грибным заболеванием молекулярные маркеры были обнаружены только для локусов Co-1 и Co-15 [11]. Идентификация таких маркеров, как в составе андских, так и мезоаме- риканских сортобразцов фасоли, напрямую способствует характеристике и сохранению генетических

ресурсов, доступных для программ улучшения сельскохозяйственных культур. Молекулярногенетическое тестирование коллекционных и селекционных образцов, культивируемых в Республике Казахстан, по указанным генам до сих пор не проводилось. Гены фасоли Co-1, Co-2 и Co-4 в трех специальных локусах отвечают за защиту от патогенов всех групп, обнаруженных во всем мире по отношению к антракнозу фасоли. Кроме того, наличие гена Co-4 в одном локусе несет ответственность за придание стойкости к группе патогенов Lindemuthianum (раса гриба), идентифицированной в Болгарии [12]. Поэтому для нас наибольший интерес представляет изучение образцов фасоли на наличие гена устойчивости к антракнозу Co-4. Результаты исследований представлены на рисунке 3.
 Все использованные праймеры обеспечили продуктивный синтез производимых фрагментов (ампликон). Количество ампликонов, зависящих от применяемых праймеров, ограничивается группой от 5 до 20 фрагментов, размеры которых ограничено визуализируются в интервале 100–2000 п. н. Все четыре сортообразца, подвергшиеся анализу, характеризовались спектром генов, определяемых количеством ампликонов, их размерами и присутствием на электрофореграмме. Также в спектре электрофореза можно наблюдать полиморфные фрагменты, полученные для различных сортов и линий при синтезе сортоспецифических праймеров (рис. 3).
Все использованные праймеры обеспечили продуктивный синтез производимых фрагментов (ампликон). Количество ампликонов, зависящих от применяемых праймеров, ограничивается группой от 5 до 20 фрагментов, размеры которых ограничено визуализируются в интервале 100–2000 п. н. Все четыре сортообразца, подвергшиеся анализу, характеризовались спектром генов, определяемых количеством ампликонов, их размерами и присутствием на электрофореграмме. Также в спектре электрофореза можно наблюдать полиморфные фрагменты, полученные для различных сортов и линий при синтезе сортоспецифических праймеров (рис. 3).
Из проростков фасоли сортообразцов «Kinghorn Wax», «Vaillant», «Лаура», «Montano» были выделены образцы ДНК СТАВ-методом. Как видно из данных, приведенных на рисунке 3, полученные образцы ДНК практически не содержали деградированных фрагментов, за исключением незначительного количества агрегатов на старте электрофореграммы, образовавшихся при ресуспендировании материала фасолевых ДНК в образцовом буфере.
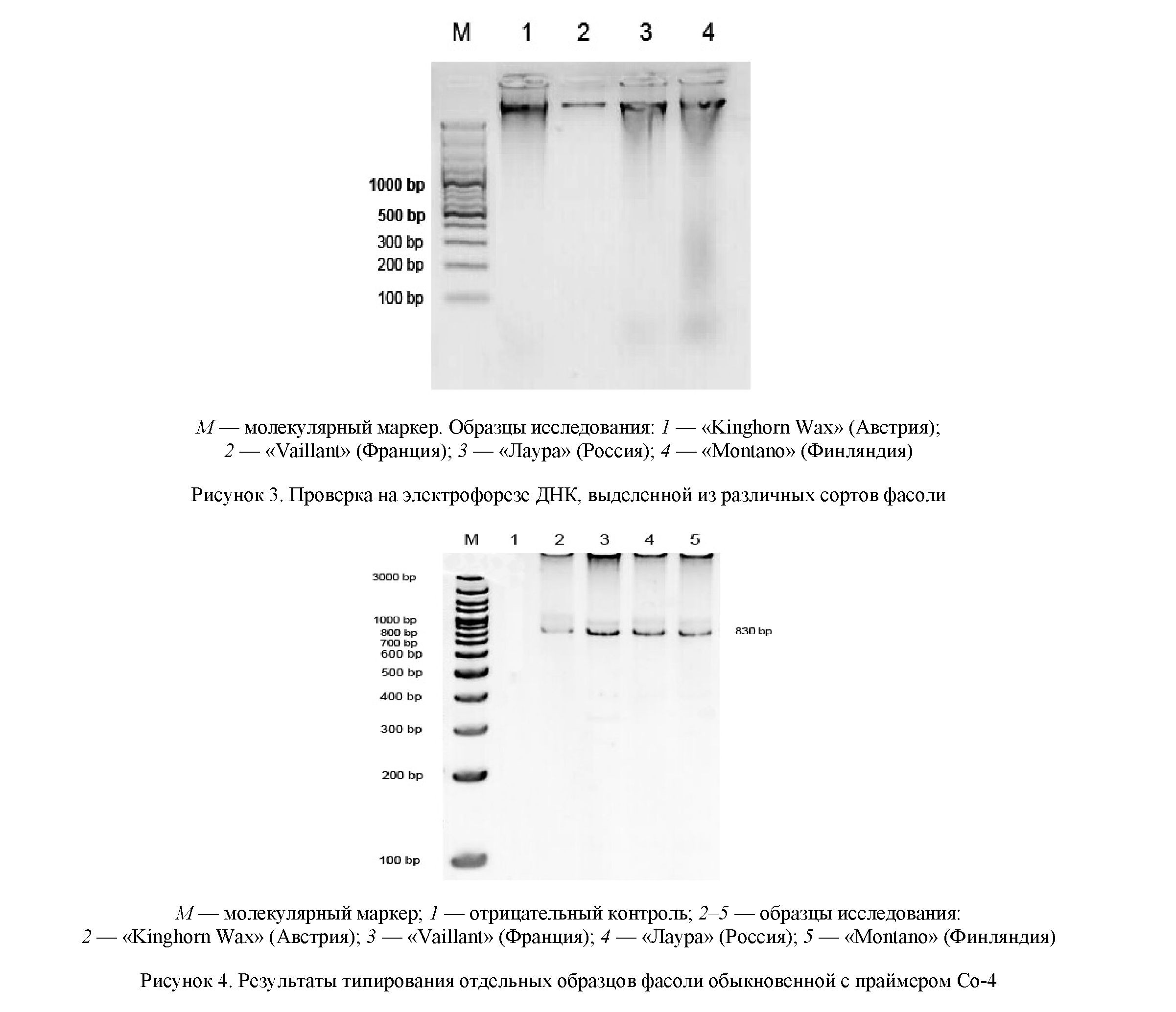
На рисунке 4 можно видеть итоги типирования четырех образцов фасоли овощной при амплификации ДНК в присутствии праймера Co-4.
Таким образом, на основе материала ПЦР-амплификации, проведенного маркером SY20 SCAR, все исследованные четыре сорта выявили наличие искомого гена Со-4. По сравнению с молекулярным маркером на всех сортах видны фрагменты данного гена размером 830 пар оснований. Наличие гена толерантности в составе ДНК этих сортообразцов свидетельствует о высокой устойчивости изучавшихся сортов к антракнозу. При этом наличие мезоамериканских генов в сортообразцах демонстрирует центрально-американское происхождение этих сортов [12]. Идентификация маркеров в андоамериканских и мезоамериканских сортах непосредственно влияет на сохранность и полноту описания генетических ресурсов в достижении программы улучшения сельскохозяйственных культур. Возможно, присутствие в геноме других генов устойчивости к антракнозу потребует маркирования по дополнительным генам, включая гены Co-1, Co-2 и Co-6. Показатели оценки по молекулярному тестированию геномов сортообразцов позволяют характеризовать перспективный исходный материал для селекции фасоли на антракнозоустойчивость в качестве источников этой устойчивости. В настоящее время изучено свыше 60 рас возбудителей антракноза у фасоли [13].
- Григорук В.В. Развитие органического сельского хозяйства в мире и Казахстане / В.В. Григорук, Е.В. Климов // Продовольственная и сельскохозяйственная Организация Объединенных Наций. — 2016. — Вып. 151. — С. 55.
- Государственный реестр селекционных достижений, допущенных к использованию в Республике Казахстан. — Астана, 2014. — 171 с.
- Кильчевский А.В. Методические указания по экологическому сортоиспытанию овощных культур в открытом грунте / А.В. Кильчевский. — М., 1985. — Ч. II. — C. 22.
- Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследования) / Б.А. Доспехов. — М.: Агропромиздат, 1985. — Вып. 5. — 351 с.
- Xia Y. A modified SDS-based DNA extraction method from raw soybean / Y. Xia, F. Chen, Y. Du, C. Liu, G. Bu, Y. Xin, B. Liu // Biosci Rep. — 2019. — P. 39.
- Oblessuc P.R. The Co-4 locus on chromosome Pv08 contains a unique cluster of 18 COK-4 genes and is regulated by immune response in common bean / P.R. Oblessuc, C. Francisco, M. Melotto // Theor. Appl. Genet. — 2015. — Vol. 128. — P. 1193. https://doi.org/10.1007/s00122–015–2500–6
- Pérez-Jaramillo J.E. Deciphering rhizosphere microbiome assembly of wild and modern common bean (Phaseolus vulgaris) in native and agricultural soils from Colombia / J.E. Pérez-Jaramillo, M. de Hollander, C.A. Ramírez // Microbiome. — 2019. — Vol. 7. — P. 114. https://doi.org/10.1186/s40168–019–0727–1
- Godfray H.C. Food system consequences of a fungal disease epidemic in a major crop / H.C. Godfray // Philos. Trans. R. Soc. Lond. B. Biol. Sci. — 2016. — Vol. 371. — P. 1709. https://doi:/10.1098/rstb.2015.0467
- Velásquez A.C. Plant-Pathogen Warfare under Changing Climate Conditions / A. C.Velásquez // Curr. Biol. — 2018. — Vol. 28. — P. 619. https://doi.org/10.1016/j.cub.2018.03.054
- Fang Y. Current and Prospective Methods for Plant Disease Detection / Y. Fang, R.P. Ramasamy // Biosensors (Basel). — 2015. — Vol. 5. — P. 537. https://doi:10.3390/bios5030537
- Genchev D. Breeding of Common Bean for Resistance to the Physiological Races of Anthracnose Identified in Bulgaria / D. Genchev // Biotechnology & Biotechnological Equipment. — 2010. — P. 1814. https://doi.org/10.1094/PD-79–0063
- de Lima Castro S.A. Genetics and mapping of a new anthracnose resistance locus in Andean common bean Paloma / S.A.de Lima Castro, M.C. Gonçalves-Vidigal, T.A.S. Gilio // BMC Genomics. — 2017. — Vol. 18. — P. 306. https://doi:10.1186/s12864– 017–3685–7
- Costa L.C. Are duplicated genes responsible for anthracnose resistance in common bean? / L.C. Costa, R.S. Nalin,, M.A. Ramalho, E.A. de Souza // PLoSONE. — 2017. — Vol. 12: e0173789. https://doi:10.1371/journal.pone.017378