Представлены результаты изучения эффективности культивирования лептоспир на жидкой питательной среде с лизированной кровью барана. Питательную среду тестировали на лептоспирах 14 серогрупп. Определено оптимальное количественное содержание лизированной крови в питательной среде для культивирования лептоспир, обеспечивающее получение бактериальной массы на 25-38% больше по сравнению с водно-сывороточной средой. Установлено, что жидкая питательная среда, содержащая 2,5% лизированной крови барана, обладает высокими ростовыми свойствами и может быть использована для длительного культивирования лептоспир без снижения их концентрации и сохранения биологических свойств.
Введение Лептоспироз - зоонозная природноочаговая инфекционная болезнь диких, домашних животных и человека, широко распространенная в различных ландшафтно- географических зонах мира.
Экономический ущерб обусловливается высокой летальностью животных (25–45% и более), снижением удоя (на 22–37%), потерей массы тела (на 18–28%), замедлением роста молодняка, понижением работоспособности у лошадей, волов и буйволов, гибелью потомства (до 90%), абортами (у 15–20% коров и у 100% свиноматок), снижением товарных качеств кож переболевших животных и выбраковкой продуктов животноводства на мясокомбинатах, нарушением воспроизводительной функции, а также затратой значительных средств на диагностические, профилактические, лечебные и карантинно- ограничительные мероприятия [1,2].
Возбудители лептоспироза относятся семейству Leptospiraceae, роду Leptospira, который включает в себя 10 видов: L. interrogans; L. biflexa (сапрофит); L. borgpetersenii; inadai; L. meyeri (сапрофит); L. noguchii; L. parva (сапрофит); L. santarosai; L. weilii; L. wolbachii (сапрофит). Наиболее изучен вид L. interrogans, по антигенным свойствам он разделен на 25 серогрупп, которые включают 180 сероваров. Непатогенные лептоспиры разделены на 38 серогрупп и 65 сероваров. Таксономическим критерием для классификации штаммов Leptospira на внутривидовом уровне служит антигенный состав клеток.
На территории Республики Казахстан возбудителями лептоспироза сельскохозяйственных животных и собак являются лептоспиры серогрупп Pomona, Tarassovi, Grippotyphosa, Sejroe, Hebdomadis, Icterohaemorrhagiae, Canicola [3,4,5]. По данным российских исследователей в природных очагах циркулируют лептоспиры серогрупп Grippotyphosa, Pomona, Sejroe, Javanica, Icterohaemorrhagiae, Bataviae, Australis, Autumnalis. В этиологической структуре лептоспирозных заболеваний человека преобладают лептоспиры серогрупп Grippotyphosa, Pomona, Icterohaemorrhagiae, Canicola, Sejroe [6,7]. Основной путь передачи инфекции - водный, меньшее значение имеют контактный и алиментарный. В организм человека и животных лептоспиры проникают через незначительные повреждения кожи и неповрежденные слизистые оболочки полости рта, носа, глаз, желудочно-кишечного и мочеполового трактов.
Для ветеринарных специалистов большое практическое значение имеет культивирование патогенных лептоспир. Вопрос культивирования лептоспир является основополагающим при диагностике лептоспироза, так как при постановке РМА (реакции микроагглютинации) используются живые культуры лептоспир, что требует содержания музея эталонных штаммов в лабораториях. Результативность бактериологического исследования, т.е. выделение культур лептоспир из патологического материала, также связана с правильным подбором питательной среды. Несомненно, что в технологической линии изготовления лептоспирозных биопрепаратов (вакцин, диагностикумов, антигенов) одним из основных этапов является получение бактериальной массы и ее концентрация нередко зависит от состава среды культивирования. Известно, что лептоспиры относятся к аэробам или микроаэрофилам и не растут на простых питательных средах. На жидких средах они растут медленно - максимальный урожай бактерий обычно получают на 5-10 день культивирования.
Для выращивания патогенных лептоспир чаще используют среду Ферворта—Вольфа (0,1%-ная пептонная вода с хлористым натрием и буферной смесью Зеренсена, рН 7,2), среду В. И. Терских (бидистиллированная вода с 10% смеси Зеренсена и 10% инактивированной сыворотки крови кролика). К средам рекомендуется добавлять один из витаминов группы В: В1 В2, В5, В6, В12. Наиболее интенсивно лептоспиры растут на жидких и полужидких питательных средах с 5-10% сыворотки крови кролика или барана (вместо сыворотки часто применяют сывороточный альбумин). По мнению авторов, эти среды имеют хорошие ростовые качества, но при этом лептоспиры обладая вариабельностью могут изменять свои биологические свойства, в определенной мере зависимой от качества сыворотки животных. К тому же от общего количества полученной крови доноров выход сыворотки составляет около 40-50% и много этапность получения сыворотки может сопровождаться контаминацией посторонней микрофлорой, приводящей к выбраковке. В этой связи целью наших исследований являлось совершенствование питательных сред для культивирования лептоспир, отличающихся простотой приготовления и высокой эффективностью и позволяющая сохранить типичные биологические свойства лептоспир.
Для достижения поставленной цели были определены следующие задачи:
- определить оптимальное количественное содержание лизированной крови в питательной среде для культивирования лептоспир;
- провести оценку разработанной питательной среды по основным параметрам, характеризующим рост лептоспир и их биологических свойств;
Материалы и методы исследований Исследования проводились в лаборатории противобактериозной биотехнологии Казахского национального аграрного университета. Для определения эффективности сред были использованы эталонные штаммы лептоспир 14 серогрупп: L.pomona, L.grippotyphosa, L.tarassovi, L.canicola, L.hebdomadis, L.icterohaemorrhagiae, L.sejroe, L.bataviae, L.autumnalis. L.australis. L.pyrogenes, L.cynopteri, L.mini. Определение ростовых свойств предлагаемой питательной среды проводили в сравнении с используемой в лабораторной практике водно-сывороточной средой, в состав которой входит сыворотка крови барана. Эффективность питательных сред определяли подсчетом числа лептоспир в поле зрения микроскопа при увеличении х200, а также методом А.П.Власова, А.С.Фоменко [1979]. Для этого готовили препарат раздавленная капля с использованием покровного стекла 18х18 мм. Данный метод основан на выявлении соотношения между площадью поля зрения и площадью, исследуемой культуры, с учетом кратности увеличения микроскопа, объемом взятой культуры [0,02см3], среднего числа лептоспир в поле зрения микроскопа и кратности разведения культуры.
При подборе сред для культивирования лептоспир важным критерием является сохранение биологических свойств лептоспир. В этой связи были изучены морфологические свойства, антигенность, вирулентность штаммов лептоспир, культивированных на исследуемой среде. Оценку качества питательной среды проводили пятикратным пассажем 14 штаммов лептоспир и сравнительным изучением интенсивности размножения лептоспир на испытуемой и на водно-сывороточной среде (инактивированная сыворотка крови барана – 10% и вода из природного источника– до 100%). Ранее проведенными исследованиями установлено, что наиболее подходящей основой для приготовления питательной среды является вода из природного источника (Киркимбаева Ж.С., 2003).
Результаты исследования. Для изготовления гемолизированной сыворотки дефибринированную кровь барана лизировали двух-трех кратным замораживанием и оттаиванием и непосредственно перед посевом лептоспир вносили в основу среды.
Было приготовлено 5 вариантов сред:
- лизированная кровь барана 1 %, вода из природного источника– до 100%;
- лизированная кровь барана 2,5 %, вода из природного источника– до 100%;
- лизированная кровь барана 5 %, вода из природного источника– до 100%;
- лизированная кровь барана 7,5 %, вода из природного источника– до 100%;
- инактивированная сыворотка крови барана – 10% и вода из природного источника – до 100%.
Засеянные культуры инкубировали в термостате при температуре в 28°С до 90 дней. Рост лептоспир наблюдали микроскопированием в темном поле на 3, 5, 7, 10 день культивирования и затем через каждые 7 дней.
Результаты исследований отражены в таблице 1. Динамика роста лептоспир в питательных средах не отличается от большинства видов бактерий и развивается по определенным фазам: лагфаза (фаза задержки роста), фаза логарифмического роста, стационарная фаза и фаза отмирания популяции клеток в культуре. При просмотре культур обращалось внимание на продолжительность фаз, наличие в культурах самоагглютинации, лизиса, дегенеративных форм лептоспир.
Таблица-1. Рост лептоспир на средах с различной концентрацией гемолизированной сыворотки
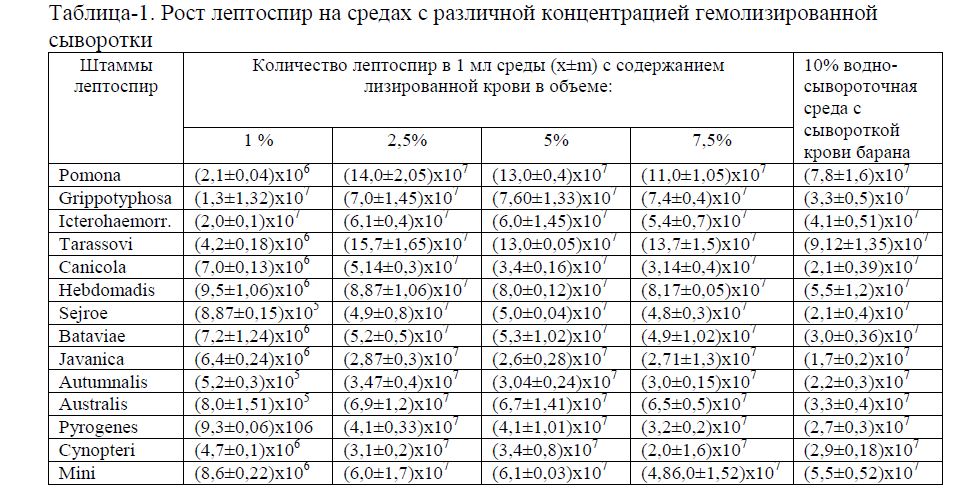
Как видно из таблицы 1 оптимальной концентрацией гемолизированной сыворотки в питательной среде для культивирования лептоспир является 2,5 %, что обеспечивает прирост бактериальной массы на 25-38% больше, чем при использовании водно- сывороточной среды. При повышении количества гемолизированной сыворотки в среде до 5% и 7,5% достоверного прироста бактериальной массы не наблюдалось. В препарате «раздавленная капля» в темном поле микроскопа лептоспиры имели вид тонких серебристо-белых нитей с нежной спиральной структурой. Помимо первичных завитков у лептоспир обнаруживают более крупные вторичные завитки, обусловливающие изгибы ее тела, вследствие чего микроорганизмы приобретают форму букв S, С. Живые бактерии в испытуемых средах быстро перемещались (прямолинейно, по кругу или вращением на месте). Лептоспиры различных серологических групп по морфологическим свойствам не отличаются. На морфологию лептоспир оказывают влияние состав среды и сроки хранения культур без пересевов.
При определении сроков сохранения лептоспир в испытуемых средах было установлено, что в среде 1 варианта (1 % лизированной крови) лептоспиры сохраняли свою жизнедеятельность от 23-31 дня, в среде 2 варианта (2,5 % лизированной крови) - 44-75 дней, в среде 3 варианта (5 % лизированной крови) – 37-45 дней, в среде 4 варианта (7,5 % лизированной крови) – 23-34 дня. На водно-сывороточной среде лептоспиры без пересевов сохранялись 55-65 дней. При изучении морфологии лептоспир в старых культурах установлено преобладание более длинных особей. Их движения приобретали змеевидный характер, периодически они становятся неподвижными, похожими на петлю веревки.
Проведенные исследования показали, что жидкая питательная среда, содержащая 2,5% лизированной крови барана, обладает высокими ростовыми свойствами и может быть использована для длительного культивирования лептоспир без снижения их концентрации. Способ приготовления среды прост и экономичен. При изготовлении водно-сывороточной среды масса эритроцитов идет в отходы. При получении 500 см3 крови от барана, можно отделить 200-250 см3 сыворотки, из которой готовится 2-2,5 литра среды. Тогда как из 100 см3 крови барана можно приготовить 4 литра жидкой питательной среды.
Таким образом, полученные результаты позволяют рекомендовать разработанную нами питательную среду с 2,5% лизированной кровью барана для практического использования.
Литература
- Малахов Ю.А. Лептоспироз животных//-Москва, Агропромиздат, 1992, 239с.
- Барышников П.И., Резниченко З.М., Апалькин В.А. Эпизоотический процесс при лептоспирозе сельскохозяйственных животных // Ветеринария, 2001, №7, С.7-9.
- Кирпичев А.Ф., Шатров А.П. Данные о распространении и этиологии лептоспироза сельскохозяйственных животных в Уральской области за 31 год [1942-1972].В кн.: Лептоспироз, -Москва, 1976, 85 с.
- Ильясов Б.К. Этиологическая структура лептоспироза животных в Республике Казахстан (эпизоотологическая карта). Авторское свидетельство № 365 от 07.1998 г.
- Киркимбаева Ж.С., Кабдулданов Т. Эпизоотологическая и эпидемиологическая характеристика лептоспироза в Казахстане// Научный журнал. Исследование, результаты, -Алматы, 2002, № 1, С.75-77.
- Соболева Г.Л., Панин А.Н. и др. Распространенность и этиологическая структура лептоспироза животных в России//Ветеринария, 2000, №12, С. 11-14.
- Малахов Ю.А., Соболева Г.Л. и др. Эпизоотическая ситуация по лептоспирозу в России // Ветеринария, 2000, №7, С.5-7.
- Киркимбаева Ж.С. Усовершенствование питательных сред для культивирования лептоспир//Вестник сельхоз.науки Казахстана, 2003, № 8,С.65-67