Рассмотрены патоморфологические проблемы токсического действия гексана на ЦНС. Отмечено, что установленные ярко выраженные нарушения в гистологических препаратах нервной ткани крыс опытной группы, подвергавшихся хроническому ингаляционному воздействию гексана (4 месяца), свидетельствуют уже не о функциональных нарушениях, а об органическом поражении головного мозга. Сделан вывод, что представленные данные можно использовать для проведения мониторинговых мероприятий на производствах.
Важной проблемой медико-биологических исследований остается выяснение механизмов формирования поражений нервной системы при хроническом воздействии алифатических углеводородов, в частности гексана. Это связано с необходимостью применения обоснованных методов профилактики и лечения, способствующих снижению структурно-функциональных нарушений в нервной ткани при интоксикации гексаном, развивающихся как при бытовых, так и при производственных условиях, работающих [1]. Гексан — это эндогенный углеводород, который содержится в выдыхаемом воздухе. При ингаляционном поступлении гексана у человека степень задержки при дыхании составляет 15-20 % [2]. Накопление гексана в тканях зависит от содержания в них липидов. В ткани головного мозга накопление идет медленнее, чем в других тканях [3]. Считается, что нейротоксическое действие гексан оказывает за счет его превращения в организме в нейротоксин гександион-2,5 [4].
Из данных литературы следует, что гексан и другие производные алифатических углеводородов являются политропным ядом, воздействующим на самые различные ткани организма. Известно, что при длительном контакте с ним в производственных условиях может развиваться функциональная и органическая патология центральной и периферической нервной системы. В частности, гексан и его метаболиты взаимодействуют с белками в нервных волокнах, формируя токсичные конгломераты [5]. Это приводит к многочисленным вариантам периферических невропатий, основу которых составляют набухания аксонов и дегенеративные изменения миелиновых оболочек, вплоть до полного разрушения. Аксональная дегенерация характеризуется большей выраженностью в дистальных отделах, с преимущественным повреждением чувствительных волокон крупного калибра. Характерны также функциональные и структурные нарушения в легких, печени, почках, сетчатке глаза, ЦНС, эндокринной и половой системах [6, 7]. Установлены острые отравления среди токсикоманов, вдыхавших пары клея, который содержал гексан и его изомеры, а также толуол. Механизм острого отравления связывают с поляризационным действием гексана на липиды клеточных мембран нейронов, который приводит к расширению мембран, увеличению их проницаемости и повышению возбудимости нейронов [8]. При хронической интоксикации развивается тяжелая периферическая невропатия. Функциональные нарушения прогрессируют в течение 2-3 месяцев после прекращения воздействия гекса-на, а восстановление протекает очень длительное время [2, 3]. Вместе с тем до настоящего времени остаются нерешенными вопросы, касающиеся особенностей изменений функционального состояния ЦНС при воздействии гексана в условиях хронического эксперимента. Несмотря на многочисленные исследования, посвященные острой и хронической интоксикации гексаном, остаются недостаточно изученными механизмы формирования в ЦНС последствий, в том числе и морфофункциональных, исследовать которые возможно лишь при помощи экспериментального моделирования интоксикации гексаном.
Исходя из изложенного выше целью наших исследований явилось морфофункциональная оценка состояния нервной ткани головного мозга крыс при воздействии гексана в условиях хронического эксперимента.
Материалы и методы исследований
Была проведена хроническая затравка гексаном в дозе 300 мг/м3 (ПДКврз) в течение 16-17 недель (4 месяца) по 4 ч ежедневно 5 дней в неделю. Затравка проводилась в стандартных 200-литровых камерах Курляндского, на половозрелых белых крысах-самцах массой 170-210 г. Животные были разделены на 2 группы: 1 группа — интактные крысы; животные 2-й группы подвергались статическому ингаляционному воздействию гексана. В течение эксперимента проводили наблюдения за динамикой изменения веса тела.
Экспериментальные животные были разделены на две группы: 1-я — контрольная — в камеру подавался воздух; 2-я — опытная, особи которой ингаляционным путем получали гексан в дозе 1/20 ЛК50. Экспериментальных животных содержали в стационарных условиях вивария при естественном освещении в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей (Страсбург, 1986) [9].
Белых крыс забивали методом декапитации. Головной мозг фиксировали в 10 %-ном растворе нейтрального формалина, с последующей заливкой в парафин. С парафиновых блоков готовились срезы головного мозга толщиной 5 мкм, окрашивали общепринятыми методами: гематоксилин-эозином, по Нисслю [10, 11]. Микроскопическое и морфометрическое исследование препаратов проводили с помощью компьютерной микроскопической видеосистемы «Quantimet 550 IW» фирмы «Laica» (Англия), с встроенным пакетом морфометрических программ.
Статистическую обработку полученных результатов осуществляли с помощью программы Excel «Описательная статистика» с использованием критерия t-Стьюдента.
Результаты и обсуждение
При ингаляционном воздействии гексана в условиях хронического эксперимента у животных 2-й группы морфометрическое и стереометрическое исследование ЦНС, отражающее соотношение удельных площадей различных структурных компонентов в коре больших полушарий головного мозга крыс, показало следующие результаты (см. табл.).

Как видно из таблицы, заметно снижалась удельная площадь нервных клеток у животных 2-й группы — на 64 %, белого вещества — на 9, капилляров — на 60 % и повышалась гиалиновая реакция в 2,3 раза по сравнению с фоновыми показателями. По стереометрическим показателям диаметр капиллярного русла у животных 2-й группы достоверно значимо сузился по сравнению с показателем животных контрольной группы (рис. 1).
Следовательно, снижение удельной площади нервных клеток, капиллярного русла, сужение их диаметра, объемной доли площади белого вещества и вместе с тем нарастание площади глиоцитов коры головного мозга белых крыс 2-й группы являются, по-видимому, компенсаторной реакцией организма на действие изучаемого токсиканта.
При гистологическом исследовании препаратов головного мозга крыс 2-й группы, получивших ингаляционное воздействие данного токсиканта, выявлены ярко выраженные нарушения нервной ткани. Отмечались множественные очаги кровоизлияний в оболочке вещества головного мозга и в желудочках, множество капилляростазов, встречались расширенные полнокровные сосуды (рис. 2).
Препараты нервной ткани характеризовались выраженными дистрофическими и деструктивными изменениями в виде хроматолиза с вакуолизацией цитоплазмы, изменением ядерной субстанции, лизисом органелл наблюдались в нейронах коры головного мозга (рис. 3).
Обнаруживались крупные клетки — «тени» причудливых форм, лишенные отростков. Вокруг патологически измененных нейронов отмечалась картина сетчатого или очагового глиоза. Крупные нейроны сморщивались, терялась осевая направленность клеток. Клетки приобретали причудливые формы с хроматолизом тигроидного вещества. Структура ядерной субстанции приобретала нечеткие извилистые очертания с наличием мелкой зернистости (рис. 4).
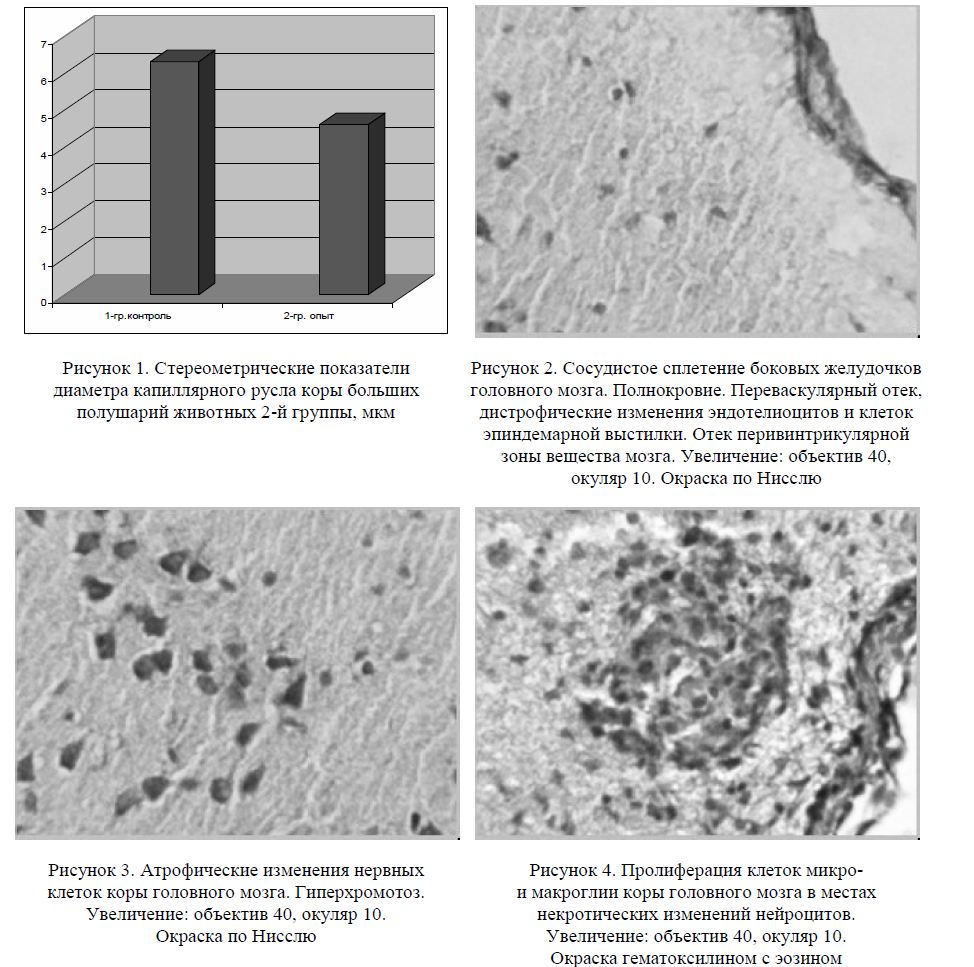
Рисунок 4. Пролиферация клеток микро-и макроглии коры головного мозга в местах некротических изменений нейроцитов. Увеличение: объектив 40, окуляр 10. Окраска гематоксилином с эозином
Ядрышко пикнотично, также просматривается с трудом. Выражена картина перицеллюлярного отека, много капилляростазов. Во всех препаратах головного мозга, в коре и в других отделах обнаруживались нервные клетки с явными признаками атрофии, которые были меньших размеров, цитоплазма их интенсивно прокрашивалась фоновыми красителями, тигроидная субстанция в виде глы-бок не определялась. Такая морфологическая картина сопровождалась обеднением коры головного мозга нейроцитами, что подтверждалось морфометрическими данными. Известно, что нарушение целостности оболочки нейрона замедляет скорость проведения импульса в нервные ткани и может создавать предпосылки для изменения интегративной деятельности нейронов [12]. Важным элементом структурной перестройки как в коре, так и в подкорковых образованиях являлась пролифератив-ная активность глиальных элементов. Особенно выраженная вокруг некротизированных нейронов и перикапиллярно. В стенках мелких церебральных сосудов отмечались признаки склерозирования и гиалиноза. Многие из них отличались неравномерностью толщины стенки и деформацией просвета (рис. 5).
Известно, что глиальные клетки являются основной частью гематоэнцефалического барьера [1]. Можно с достаточной определенностью предполагать, что развитие патологических изменений гли-альных клеток в ответ на токсическое воздействие гексана приводит к увеличению его проницаемости, что, в свою очередь, сопровождается нарушением гомеостаза ЦНС животных опытной группы. При исследовании препаратов головного мозга крыс 2-й группы также значительные изменения выявлялись и в структуре мозжечка (рис. 6).
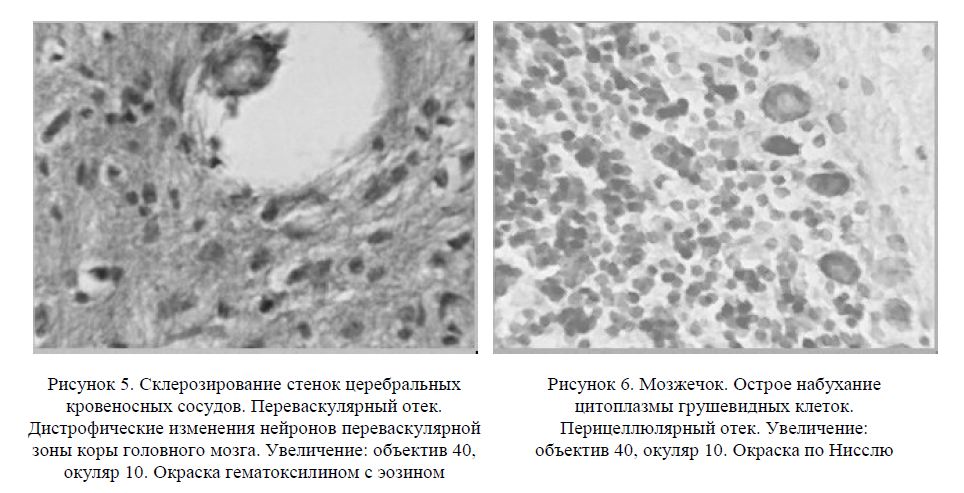
Морфологические изменения наблюдались особенно в грушевидных клетках, которые подвергались набуханию, вакуолизировались и за счет периваскулярного отека выталкивались глубоко в молекулярный слой. Также отмечались значительные участки выпадения грушевидных клеток. Известно, что вакуолизация нейронов свидетельствует о процессах деградации нервных клеток [1].
Таким образом, длительная ингаляция гексаном (4 месяца) у животных 2-й группы приводила к ярко выраженным органическим поражениям структур головного мозга, и прежде всего коры — как наиболее чувствительной к токсическим и ишемическим влияниям. Все перечисленные выше изменения в гистологических срезах указывают на экстремальный характер воздействия изучаемого токсиканта на организм.
Выводы
- При морфологических исследованиях у животных опытной группы отмечались ярко выраженные органические поражения структур головного мозга и коры.
- При морфометрическом и стереометрическом анализе соотношение удельных площадей различных структурных компонентов в коре больших полушарий головного мозга крыс имело тенденцию к снижению как компенсаторная реакция.
- Комплексное гистологическое исследование ЦНС крыс опытной группы при ингаляционном воздействии гексана в условиях хронического эксперимента характеризовалось ярко выраженными нарушениями, что свидетельствует уже не о функциональных нарушениях, а об органическом поражении головного мозга.
Список литературы
- Соседова Л.М., Кудаева И.В., Титов Е.А. и др. Морфологические и нейрохимические эффекты в отдаленном периоде ртутной интоксикации (экспериментальные данные) // Медицина труда и промышленная экология. — 2009. — № 1. — С. 37-42.
- Mutti A. et al // J. Intern. Arch. Occup. Environ. Health. — 1982. — 51. — № 1. — P. 45-54; Brit. J. Ind. Med. — 1984. — Vol. 41. — № 4. — P. 533-538.
- Baker T.S., RickartD.E. // Toxicol. a. Appl. Pharmacol. — 198 — Vol. 61. — № 3. — P. 414-422.
- Iwasaki K., Tsuruta H. // Ind. Health. — 1984. — 22. — № 3. — P. 177-187.
- Graham D.G., Abou-Donia B.J. // Toxicol. a .Environ. Health. — 1980. — 6. — № 3. — P. 621-631.
- Тихонова Г.П.// Гигиена труда. — 1984. — № 3. — С. 38-40.
- Damstra T. // Yale I. Biological a. Med. — 1978. — 51. — № 4. — P. 457-468.
- Jorgenson H., Cohr W. // Scand. J. Work, Environ. and Health. — 1981. — 7. — № 3. — P. 129-168.
- Scelsi R. et al // J. Clin. Toxicol. — 1981 (1982). — Vol. — № 12. — P. 1387-1393.
- Данилов Р.К., Быков В.Л. Руководство по гистологии. — СПб.: Спецлит, 2001. — 496 с.
- Коржевский Д.Э. Краткое изложение основ гистологической техники для врачей и лаборантов-гистологов. — СПб.:ООО «Кроф», 2005. — 48 с.
- KochM., Bottger C. et. al. // Glia. — 2008. — Oct., 3. [Epub ahead of print].