В статье отмечено, что полиморфные варианты генов, связанных с детоксикацией и поддержанием редокс-баланса организма, могут быть ассоциированы с индукцией активных радикалов и оксидатив-ным стрессом, возникающим в ответ на облучение. Представлен анализ распределения частот генотипов и аллелей по полиморфным локусам генов OGG1, ERCC2, PARP1, XRCC4, XRCC3 и ATM в группе лиц, подвергшихся хроническому радиационному воздействию. Также приведен анализ генотипов между группами тюркской и славянской этнической принадлежности и группами, разделенными по половому признаку.
Введение
Длительное облучение в малых и средних диапазонах доз вызывает целый ряд процессов и эффектов, которые могут не регистрироваться при облучении в высоких дозах. Могут реализовываться нестабильность генома, экспрессия генов, индукция синтеза белков, генные мутации, аберрации хромосом, повышение чувствительности к последующим воздействиям и многое другое [1-3]. Так, в лимфоцитах лиц, подвергшихся хроническому радиационному воздействию на реке Теча, в отдаленные периоды после начала радиационного воздействия наблюдалось повышение уровня соматических мутаций в гене Т-клеточного рецептора, частоты хромосомных аберраций (дицентриков, ацентрических колец, кольцевых хромосом и транслокаций), числа клеток с блоком клеточного цикла, ранней апоптотической гибели [4-6]. Кроме того, было отмечено возрастание риска развития эффектов стохастической природы, в первую очередь лейкозов, при этом время регистрации пика возникновения лейкемий зависит, главным образом, от дозы [7].
Молекулярные механизмы реализации отдаленных последствий хронического радиационного воздействия на сегодняшний день недостаточно полно ясны. Однако накоплено множество данных, указывающих на то, что точечные мутации, частота встречаемости которых в популяции не менее 1 % (однонуклеотидные генетические полиморфизмы), в генах систем репарации ДНК, контроля клеточного цикла и апоптоза могут модифицировать ответ организма на радиационное воздействие и влиять на развитие отдаленных последствий. Полиморфизмы в гене OGG1, участвующем в эксцизи-онной репарации оснований, связаны с повышенным уровнем хромосомных аберраций [8] и мутаций в гене TP53 [9], а также с онкопатологией мочевого пузыря [10], желчного пузыря [11], поджелудочной железы [12], прямой кишки [13] и легких [14]. Полиморфные варианты гена ERCC2, относящегося к системе эксцизионной репарации оснований, были связаны с повышенной чувствительностью к 5-флюороурацилу в сочетании с облучением [15], с повышенным риском развития рака молочной железы у женщин, подвергавшихся низкоинтенсивному воздействию ионизирующего излучения [16], и c рядом других онкологических заболеваний [14, 17, 18]. Односайтовые замены в гене белка PARP1, который вовлечен в процесс эксцизионной репарации нуклеотидов, ассоциированы с такими эффектами, как повышенный уровень соматических мутаций в гене TP53 [9], снижение продолжительности жизни [19], а также с повышенным риском развития онкопатологий различных локализаций [20-22].
Односайтовые замены в генах системы репарации ДНК по типу негомологичного соединения концов также могут влиять на развитие отдаленных эффектов. Так, у носителей полиморфных генов XRCC4 был обнаружен повышенный риск развития рака молочной железы [23, 24]. В гене XRCC3, относящемся к системе гомологичной рекомбинации ДНК, встречаются однонуклеотидные полиморфизмы, ассоциированные c увеличением числа хромосомных делеций и транслокаций [8], а также с онкопатологиями различных локализаций: мочевого пузыря [25], молочной железы [26], толстой кишки [27], легких [14].
Помимо систем репарации ДНК, важную роль в поддержании гомеостаза организма играет и группа ферментов, регулирующих клеточный цикл. Например, полиморфизмы в гене ATM связаны с повышенным риском развития радиационно-индуцированного папиллярного рака щитовидной железы [28] и с повышенным риском развития рака молочной железы [29]. Таким образом, наличие полиморфизмов, ассоциированных с неэффективной репарацией и нарушениями регуляции клеточного цикла, в сочетании с генотоксическим действием ионизирующего излучения могут стать причиной повышенной вероятности развития отдаленных последствий облучения.
Характеристика обследованных лиц
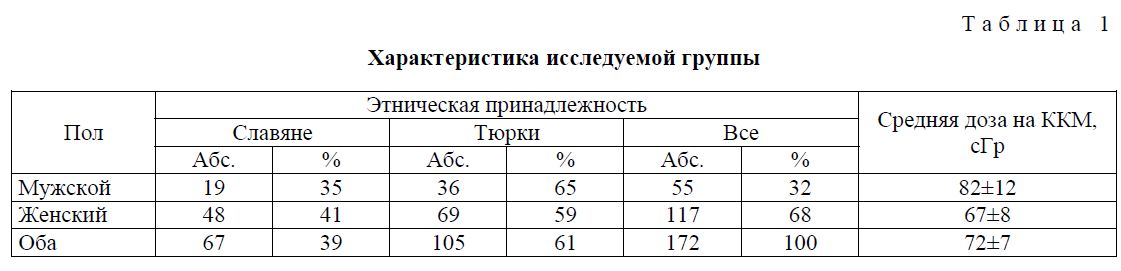
В ходе работы были обследованы 172 человека. Данную группу составили люди, подвергшиеся хроническому радиационному воздействию в 1950-1960 гг. в результате загрязнения радиоактивными отходами ПО «Маяк» бассейна реки Течи [30]. Население прибрежных сел подверглось действию комбинированного внешнего (преимущественно у-) и внутреннего у- и Р-излучения с низкой ЛПЭ. Основными источниками внешнего у-излучения являлись: вода, донные отложения и пойменные почвы, а также участки территории населенных пунктов, загрязненные в результате хозяйственной деятельности (поливные огороды, механический перенос радиоактивности). Внутреннее облучение было обусловлено радионуклидами, поступавшими в организм с речной водой и продуктами питания местного производства (молоко, рыба, овощи с поливных огородов). Наиболее высокие уровни суммарной Р-активности были обнаружены в рыбе и мясе водоплавающей птицы. Менее загрязненными смесью радионуклидов были молоко и овощи [31].
Основным дозообразующим радионуклидом был 90Sr. Являясь аналогом кальция, стронций накапливался и долгое время удерживался в костной ткани. Кроме того, значимый вклад в формирование дозы внесли 137Cs и 89Sr, но, благодаря короткому периоду полураспада 89Sr и быстрому выведению из организма 137Cs, облучение за счет этих радионуклидов реализовывалось только в первые 5 лет после их поступления [19]. Все обследованные имели индивидуальную реконструированную дозу на ККМ. Средняя доза на красный костный мозг составила 0,72±0,07 Гр. 61 процент обследованных принадлежал к тюркской этнической группе (татары и башкиры), а 39 % — к славянской (преимущественно русские). В группе присутствовали как мужчины (32 %), так и женщины (68 %). Характеристика группы представлена в таблице 1.
Выделение ДНК и генотипирование
В исследовании использовались замороженные образцы крови, сохраняемые в банке тканей ФБГУН УНПЦ РМ. Одна часть ДНК была выделена с помощью набора реагентов iPrep PureLink gDNA Blood Kit на приборе Applied Biosystems Library Builder, а другая — методом фенол-хлороформной экстракции ДНК, включающем ряд этапов. После размораживания 700 мкл крови переносили в пробирку эппендорф и добавляли 700 мкл ASSC. Центрифугировали при 12000 об./мин 2 минуты. К осадку добавляли 1400 мкл ASSC, перемешивали и вновь центрифугировали при 12000 об./мин 2 минуты. К осадку добавляли 270 мкл ацетатного буфера, 30 мкл 10 % SDS, инкубировали при 37 °С 1 час. Затем проводилась очистка фенол-хлороформной смесью (50/50). После центрифугирования (12000 об./мин — 10 минут) надосадочную жидкость переносили в чистую пробирку и осаждали ДНК 1000 мкл спирта (100 %). После кратковременного центрифугирования проводили отмывку 70 %-ным спиртом. Получившийся осадок ДНК высушивали и растворяли в 100 мкл де-ионизированной воды.
В исследование были включены полиморфизмы генов OGG1 (rs1052133), ERRC2 (rs13181), PARP1 (rs1136410), XRCC4 (rs2075685), XRCC3 (rs861539) и ATM (rs664677).
Генотипирование образцов и детекция результатов осуществлялись методом полимеразной цепной реакции в реальном времени на приборе Applied Biosystems StepOnePlus с использованием наборов реагентов ФЛЭШ производства фирмы Gen-Expert (Москва).
Статистическую обработку результатов осуществляли с использованием программного комплекса SPSS Statistics 17.0. Сравнение распределения генотипов для групп, отличающихся по этническому или половому признаку, и проверку на соответствие равновесному распределению Харди-Вайнберга проводили с помощью критерия %2.
Результаты и обсуждение
Для исследования были выбраны 6 полиморфизмов генов систем эксцизионной репарации оснований (OGG1), эксцизионной репарации нуклеотидов (ERCC2, PARP1), негомологичного соединения концов ДНК (XRCC4), гомологичной рекомбинации (XRCC3) и контроля клеточного цикла (ATM), так как, по литературным данным, генетические варианты в данных системах могут быть связаны с увеличением уровня соматических мутаций, хромосомных аберраций и повышением вероятности развития онкопатологий [8, 32, 33]. Результаты генотипирования представлены в таблице 2.
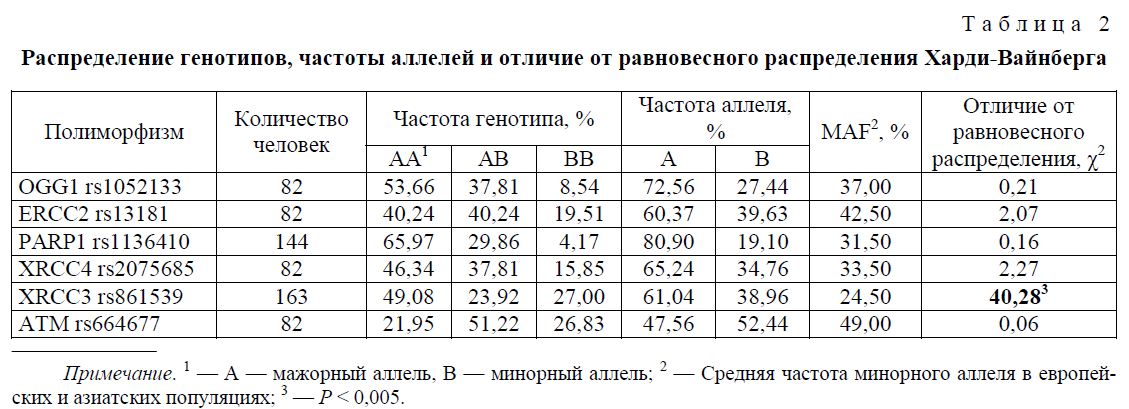
Частоты минорных аллелей генов OGG1, PARP1 и XRCC3 достоверно отличались от соответствующих средних частот для объединенной европейско-азиатской популяции. Вариант OGG1 326Cys в исследованной группе встречался реже (P = 0,05), как и PARP1 742Ala (P = 0,03), а аллель XRCC3 241Met наблюдался значительно чаще (P < 0,01). Однако при этом они полностью согласовались со средними частотами для исключительно европейских популяций.
Распределение генотипов по всем исследованным локусам, кроме XRCC3 rs861539, соответствовало закону равновесного распределения Харди-Вайнберга, что может говорить об отсутствии значимых факторов отбора в отношении данных вариантов в исследованной популяции. Для XRCC3 rs861539 наблюдалось значительное снижение числа гетерозигот при равном увеличении количества гомозигот по сравнению с ожидаемым распределением (%2 = 40,28; Р < 0,01).
Было проведено сравнение распределения генотипов между группами тюркской и славянской этнической принадлежности, а также между группами, разделенными по половому признаку. Результаты анализа приведены в таблице 3.
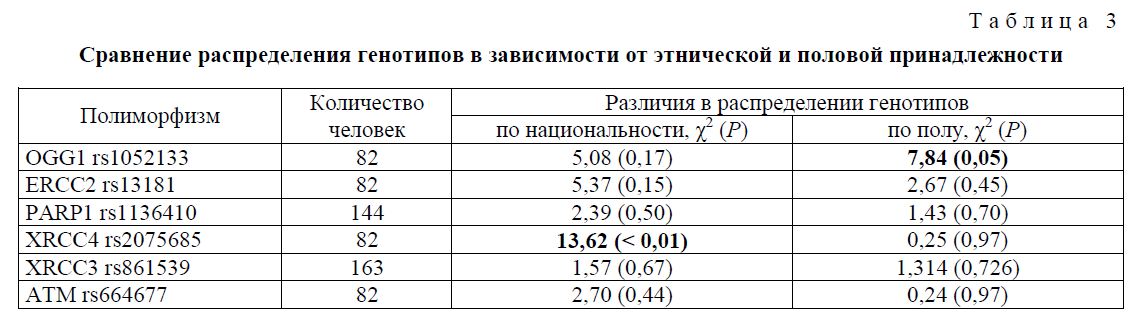
Распределение генотипов гена XRCC4 сильно отличалось между этническими группами. У тюр-китов наблюдалось 65,5 % гомозигот по мажорному аллелю, 29,2 % гетерозигот и 8,3 % гомозигот по минорному аллелю, в то время как для славян распределение составляло 23,5; 50,0 и 26,6 % соответственно. Также отмечалось различие в распределении генотипов варианта OGG1 rs1052133 между мужчинами и женщинами. Среди мужчин гомозиготы по мажорному аллелю встречались значительно чаще (76,0 %), чем среди женщин (43,9 %).
Заключение
Таким образом, результаты предварительного исследования показывают, что частоты минорных аллелей генов OGG1, PARP1 и XRCC3 достоверно отличались от соответствующих средних частот для объединенной европейско-азиатской популяции, однако при сравнении с частотами в европейской популяции различий не наблюдалось.
Распределение генотипов по всем исследованным локусам, кроме XRCC3 rs861539, соответствовало закону равновесного распределения Харди-Вайнберга, что может говорить об отсутствии значимых факторов отбора в отношении данных вариантов в исследованной популяции.
Распределение генотипов гена XRCC4 значительно отличалось между этническими группами. Также отмечалось различие в распределении генотипов варианта OGG1 rs1052133 между мужчинами и женщинами.
На данном этапе работы не представляется возможным сделать окончательные выводы о причине несоответствия распределения гена XRCC3 и различий в частоте встречаемости минорных аллелей генов OGG1, PARP1, XRCC3. В связи с этим в дальнейшем планируется продолжение исследований на расширенной группе людей.
Список литературы
- Пелевина И.И., Алещенко А.В., Антощина М.М., Рябченко Н.И., Семенова Л.П., Серебряный А.М. Индивидуальная вариабельность в проявлении адаптивного ответа клеток человека на воздействие ионизирующей радиации. Подходы к ее определению // Радиационная биология. Радиоэкология. — 2007. — Т. 47, № 6. — С. 658-666.
- Smirnov D.A., Morley M., Shin E., Spielman S., Cheung V.G. Genetic analysis of radiation-induced changes in human gene expression // Nature. — 2009. — 459, No. 28. — P. 587-591.
- Limoli C.L., Ponnaiya B., Corcoran J.J., Giedzinski E., Kaplan M.I. et al. Genomic instability induced by high and low LET ionizing radiation // Adv Space Res. — 2000. — 25. — P. 2107-2117.
- Маркина Т.Н., Веремеева Г.А., Блинова Е.А., Аклеев А.В. Блок клеточного цикла и активность апоптоза лимфоцитов периферической крови (ЛПК), частота мутаций в генахTCR в отдаленные сроки у людей, подвергшихся хроническому радиационному воздействию // Вопросы радиационной безопасности. — 2011. — № 1. — С. 41-49.
- Veremeyeva G.A., Akushevich I.V., Ukraintseva S. V., Yashin A.I., Epifanova S.B., Blinova E.A., Akleyev A.V. A new approach to individual prognostication of cancer development under conditions of chronic radiation exposure // Int. Journal of Low Radiation. — 2010. — 7, No. 1. — P. 53-80.
- Blinova E.A., Veremeyeva G.A., Akleyev A.V. Apoptosis of peripheral blood lymphocytes and mutations in the gene of the T-cell receptor in survivors of chronic radiation exposure // Health Phys. — 2012. — 103, No. 1. — P. 58-60.
- Krestinina L., Yu D.L., Preston E. V., Ostroumova E.V. et al. Protracted radiation exposure and cancer mortality in the Techa River Cohort // Radiat.Res. — 2005. — 164(5). — P. 602-611.
- Минина В.И. Генетический полиморфизм и хромосомные аберрации, индуцированные радиацией // Сибирский медицинский журнал. — 2012. — № 3.
- Cho S. et al. Associations between polymorphisms in DNA repair genes and TP53 mutations in non-small cell lung cancer // Lung Cancer. — Vol. 73, No. 1. — P. 25-31.
- Arizono K., Osada Y., Kuroda Y. DNA repair gene hOGG1 codon 326 and XRCC1 codon 399 polymorphisms and bladder cancer risk in a Japanese population // Jpn. J. Clin. Oncol. — 2008. — 38, No. 3. — P. 186-191.
- Jiao X. et al. hOGG1 Ser326Cys polymorphism and susceptibility to gallbladder cancer in a Chinese population // Int. J. Cancer. — 2007. — 121, No. 3. — P. 501-505.
- Zhang J. et al. Sequence variants in antioxidant defense and DNA repair genes, dietary antioxidants, and pancreatic cancer risk // Int. J. Mol. Epidemiol. Genet. — 2011. — 2, No. 3. — P. 236-244.
- Canbay E. et al. Association of APE1 and hOGG1 polymorphisms with colorectal cancer risk in a Turkish population // Curr. Med. Res. Opin. — 2011. — V 27, No. 7. — P. 1295-1302.
- Hung R.J., Baragatti M., Thomas D., McKay J., Szeszenia-Dabrowska N., Zaridze D., Lissowska J., Rudnai P., Fabianova E., Mates D., Foretova L., Janout V., Bencko V., Chabrier A., Moullan N., Canzian F., Hall J., Boffetta P., Brennan P. Inherited predisposition of lung cancer: a hierarchical modeling approach to DNA repair and cell cycle control pathways // Cancer Epidemiol Biomarkers Prev. — 2007. — Vol. 16, No. 12. — P. 2736-2744.
- Duldulao M.P., Lee W., Nelson R.A., Ho J., Le M., Chen Z., Li W., Kim, Garcia-Aguilar J. Gene polymorphisms predict toxicity to neoadjuvant therapy in patients with rectal cancer // Cancer. — 2013. — Vol. 119, No. 5. — P.1106-1112.
- Rajaraman P., Bhatti P., Doody M.M., Simon S.L., Weinstock R.M., Linet M.S., Rosenstein M., Stovall M., Alexander B.H., Preston D.L., Sigurdson A.J. Nucleotide excision repair polymorphisms may modify ionizing radiation-related breast cancer risk in US radiologic technologists // J. Cancer. — 2008. — Vol. 123, No. 11. — P. 2713-2716.
- Kiyohara C., Yoshimasu K. Genetic polymorphisms in the nucleotide excision repair pathway and lung cancer risk: a meta-analysis // Int. J. Med. Sci. — 2007. — 4, No. 2. — P. 59-71.
- Mocellin S., Verdi D., Nitti D. DNA repair gene polymorphisms and risk of cutaneous melanoma: a systematic review and meta-analysis // Carcinogenesis. — 2009. — 30, No. 10. — P. 1735-1743.
- Walston J.D. Inflammation and stress-related candidate genes, plasma interleukin-6 levels, and longevity in older adults // Exp. Gerontol. — 2009. — 44, No. 5. — P. 350-355.
- Kim J., Pyun J.A., Cho S.W., Lee K., KwackK. Lymph node metastasis of gastric cancer is associated with the interaction between poly (ADP-ribose) polymerase 1 and matrix metallopeptidase 2 // DNA Cell Biol. — 2011. — 30, No. 12. — P. 10111017.
- Figueroa J.D. et al. Genetic variation in the base excision repair pathway and bladder cancer risk // Hum. Genet. — 2007. — 121, No. 2. — P. 233-242.
- Smith T.R., Levine E.A., Freimanis R.I., Akman S.A., Allen G.O., Hoang K.N., Liu-Mares W., Hu J.J. Polygenic model of DNA repair genetic polymorphisms in human breast cancer risk // Carcinogenesis. — 2008. — Vol. 29, No. — 2132-2138.
- Sehl M.E., Langer L.R., Papp J.C., Kwan L., Seldon J.L., Arellano G., Reiss J., Reed E.F., Dandekar S., Korin Y., Sinsheimer J.S., Zhang Z.F., Ganz P.A. Associations between single nucleotide polymorphisms in double-stranded DNA repair pathway genes and familial breast cancer // Clin. Cancer Res. — 2009. — Vol. 15, No. 6. — P. 2192-2203.
- Zhou L.P., Luan H., DongX.H., Jin G.J., Ma D.L., Shang H. Association of functional polymorphisms of the XRCC4 gene with the risk of breast cancer: a meta-analysis // Asian Pac. J. Cancer Prev. — 2012. — 13, No. 7. — P. 3431-3436.
- Figueroa J.D., Malats N., Rothman N., Real F.X., Silverman D., Kogevinas M., Chanock S., Yeager M., Welch R., DosemeciM., Tardon A., Serra C., Carrato A., Garcia-Closas R., Castano-Vinyals G., Garcia-Closas M. Evaluation of genetic variation in the double-strand break repair pathway and bladder cancer risk // Carcinogenesis. — 2007. — Vol. 28, No. 8. — P. 1788
- Silva S.N., Tomar M., Paulo C., Gomes B.C., Azevedo A.P., Teixeira V., Pina J.E., Rueff J., Gaspar J.F. Breast cancer risk and common single nucleotide polymorphisms in homologous recombination DNA repair pathway genes XRCC2, XRCC3, NBS1 and RAD51. Cancer Epidemiol. 2010 Feb;34(1):85-92.
- Krupa R., Sliwinski T., Wisniewska-Jarosinska M., Chojnacki J., Wasylecka M., Dziki L., Morawiec J., Blasiak J. Polymorphisms in RAD51, XRCC2 and XRCC3 genes of the homologous recombination repair in colorectal cancer — a case control study // Mol. Biol. Rep. — 2011. — 38, No. 4. — P. 2849-2854.
- Akulevich N.M., Saenko V.A., Rogounovitch T.I., Drozd V.M., Lushnikov E.F., Ivanov V.K., Mitsutake N., Kominami R., Yamashita S. Polymorphisms of DNA damage response genes in radiation-related and sporadic papillary thyroid carcinoma // Endocr. Relat. Canc — 2009. — Vol. 16, No. 2. — P. 491-503.
- Zhao L., Gu A., Ji G., Zou P., Zhao P., Lu A. The Association between ATM IVS 22-77 T>C and Cancer Risk: A Meta-Analysis // PLoS One. — 2012. 7, No. 1. — P. e29479. doi:10.1371/journal.pone. 2012.
- Аклеев А.В. Медико-биологические и экологические последствия радиоактивного загрязнения реки Теча / Акле-ев А.В., Киселев М.Ф. — М.: Медбиоэкстрем, 2000. — 532 с.
- ДегтеваМ.О., ВоробьеваМ.И., ТолстыхЕ.И., Шагина Н.Б., Кожеуров В.П. Дозиметрическая система реки Теча: реконструкция доз для оценки риска радиационных последствий // Вопросы радиационной безопасности. — 2000. — № 4. —С. 36-46.
- Tolstykh E.I., Degteva M.O., Peremyslova L.M., Shagina N.B., Shishkina E.A., Krivoshchapov V.A., Anspaugh L.R., Napier B.A. Reconstruction of long-lived radionuclide intakes for Techa riverside residents: strontium-90 // Health Physics. — 2011. — 101. — P. 28-47.
- Сальникова Л.Е. Генетическая детерминация эффектов ионизирующих излучений: цитогенетические и эпидемиологические показатели: Дис. ... — М., 2011.